marie45310
Admin fondatrice


  
Date de naissance : 05/03/1954
Age : 70
Localisation : Epieds en beauce(loiret)
Humeur : Je vais bien
 | 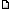 Sujet: Décompensation respiratoire Sujet: Décompensation respiratoire  Mar 20 Déc - 21:02 Mar 20 Déc - 21:02 | |
| Décompensation respiratoire
des BPCOL'insuffisance respiratoire aiguë survient d'autant plus fréquemment chez le patient atteint d'une BPCO que l'affection pulmonaire est sévère. La BPCO est définie comme un état pathologique, caractérisé par la présence d'une obstruction au débit gazeux, en rapport avec une bronchite chronique ou un emphysème ; l'obstruction des voies aériennes est généralement progressive, elle peut s'accompagner d'une hyperactivité et elle peut être partiellement réversible. Le développement d'une insuffisance respiratoire aiguë pose des problèmes physiopathologiques, dont la compréhension conduit à la mise en oeuvre de thérapeutiques adaptées. Le diagnostic positif et le bilan étiologique sont en général faciles. Le développement des techniques de ventilation non invasives permet, dans un certain nombre de cas, de passer le cap aigu et semble constituer un facteur majeur de progrès en termes de morbidité et de mortalité. DONNÉES PHYSIOPATHOLOGIQUESLa physiopathologie des bronchopathies chroniques obstructives est caractérisée par des anomalies des propriétés mécaniques du système respiratoire, une charge importante imposée aux muscles respiratoires, une altération des échanges gazeux intrapulmonaires, et des modifications de l'activité des centres respiratoires [Vous devez être inscrit et connecté pour voir ce lien] . Modifications mécaniquesLa limitation des débits expiratoires résulte d'une diminution de la pression de rétraction élastique du poumon chez les patients emphysémateux et du rétrécissement des voies aériennes dans le cadre de la bronchite chronique. C'est donc la maladie respiratoire chronique sous-jacente qui, du fait des lésions anatomopathologiques, est responsable de la limitation des débits expiratoires. Cette gêne au débit expiratoire ne peut pas être contrebalancée en soufflant plus fort au temps expiratoire. En effet, en augmentant l'effort expiratoire, le patient accroît la pression pleurale qui devient positive et aboutit à un phénomène antagoniste de l'expiration dans la mesure où elle comprime les bronches, réduisant leur calibre et donc les débits expiratoires. Ce phénomène est illustré par le fait que certains patients très distendus limitent la chute de pression entre l'alvéole et la bronche en pinçant les lèvres à l'expiration. C'est une méthode utilisée également en kinésithérapie respiratoire. L'analyse de la courbe débit/volume fournit des informations importantes. Chez le sujet normal [Vous devez être inscrit et connecté pour voir ce lien] , la courbe en trait continu représente les variations des débits en fonction des volumes pendant l'inspiration et l'expiration forcées. Cette manoeuvre permet de définir l'enveloppe maximale des débits dont le sujet peut se servir et ceci à tous les volumes pulmonaires. La courbe expiratoire a une forme grossièrement triangulaire, atteignant une valeur maximale à un volume d'environ 80 % de la capacité vitale (CV), c'est-à-dire très proche de la capacité pulmonaire totale. La courbe inspiratoire a une forme semi-circulaire. Au repos, le sujet évolue à partir de la capacité résiduelle fonctionnelle (CRF) et n'utilise qu'une très petite partie de ce cadre maximal. Les flux inspiratoire et expiratoire sont éloignés des flux maximaux. Au cours d'un exercice avec hyperventilation, l'inspiration débute à partir d'un volume qui est inférieur à la CRF : le diaphragme est ainsi placé dans une configuration plus avantageuse sur le plan énergétique, ce qui permet l'utilisation du recul élastique de la paroi comme un agoniste inspiratoire. Le sujet augmente le volume courant, le flux maximal inspiratoire et expiratoire. Cependant, même en cas d'exercice maximal, il n'atteint jamais les lignes continues. En d'autres termes, le patient normal reste toujours en deçà des limites théoriques maximales dont il dispose. Les patients atteints d'une BPCO sont dans une situation totalement différente. La courbe débit/volume montre une réduction considérable de l'enveloppe des débits. Quel que soit le volume considéré, les débits expiratoire et inspiratoire forcés sont diminués par rapport à l'enveloppe d'un sujet normal. De plus, la capacité vitale forcée (CVF) est rédu ite. Toutefois le débit dépend toujours de la configuration pulmonaire : il est plus élevé à haut volume pulmonaire qu'à bas volume pulmonaire. Au repos, le patient dépasse l'enveloppe débit-volume maximal pendant l'expiration alors qu'il ne la dépasse pas pendant l'inspiration. Ceci traduit le collapsus des bronches qui sont pathologiques et qui survient précocement lorsque la pression pleurale est positive comme au cours d'une expiration forcée, rendant compte de la différence entre expiration forcée et spontanée. Ainsi, au cours d'un effort expiratoire maximal, le sujet BPCO contracte ses muscles expiratoires, et augmente de manière substantielle les pressions pleurales, ce qui diminue le flux expiratoire au lieu de l'accroître. Ce phénomène est généralement constaté quand le volume expiratoire maximal seconde (VEMS) est inférieur à 1,2 litres. L'analyse de la courbe débit/volume du patient BPCO montre que lorsqu'il doit augmenter la ventilation, il ne peut augmenter ni le flux expiratoire ni diminuer son volume pulmonaire. Les deux solutions qui sont offertes sont l'augmentation du flux inspiratoire et/ou l'augmentation du volume pulmonaire. De fait, au cours de l'hyperventilation ou en cas de poussée aiguë, le patient augmente le volume de fin d'expiration et le flux inspiratoire. Ces deux phénomènes dépendent fondamentalement de l'action des muscles inspiratoires. C'est ainsi que bien que la charge soit essentiellement expiratoire, la compensation pour la pompe ventilatoire est essentiellement inspiratoire. Fig. 1. Courbe débit-volume d'un sujet normal (à gauche), et d'un sujet ayant une BPCO sévère (à droite). Pour explication, voir texte.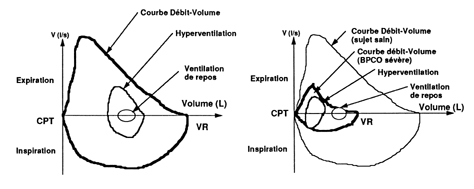 Il est intéressant d'exprimer l'augmentation du flux inspiratoire à partir de l'analyse de l'équation de la ventilation. En effet, la ventilation/minute Il est intéressant d'exprimer l'augmentation du flux inspiratoire à partir de l'analyse de l'équation de la ventilation. En effet, la ventilation/minute  est le produit du volume courant (VT) par la fréquence respiratoire (FR) : est le produit du volume courant (VT) par la fréquence respiratoire (FR) : = VT × FR (équation 1)Comme la fréquence respiratoire est l'inverse de la durée totale du cycle respiratoire (Ttot) : = VT × FR (équation 1)Comme la fréquence respiratoire est l'inverse de la durée totale du cycle respiratoire (Ttot) :  = VT × = VT ×  (équation 2)En multipliant le numérateur et le dénominateur par le temps inspiratoire (TI) ou expiratoire (TE), la deuxième équation devient : (équation 2)En multipliant le numérateur et le dénominateur par le temps inspiratoire (TI) ou expiratoire (TE), la deuxième équation devient : (équation 3)À partir de cette troisième équation, il apparaît que la seule façon de compenser une diminution du flux expiratoire (rapport VT/TE), comme cela est observé en cas de décompensation, est d'augmenter le rapport TE/Ttot.Or, Ttot = TI + TE ; donc si TE/Ttot augmente, TI/Ttot diminue. Ceci n'est possible que si le débit inspiratoire (VT/TI) augmente, ce qui représente une activité inspiratoire accrue. Lorsque cette activité dépasse un certain seuil, une fatigue musculaire peut se développer.Une seconde modalité pour faire face à un accroissement des besoins ventilatoires est l'augmentation du volume pulmonaire, ce qui présente quelques avantages : la pression de recul élastique augmente (force de rétraction contribuant à l'expiration) et les résistances des voies aériennes diminuent avec l'augmentation du volume pulmonaire, ce qui réduit quelque peu le travail résistif expiratoire et stabilise les voies aériennes. Néanmoins cette hyperinflation a des conséquences défavorables sur l'action et la coordination des muscles inspiratoires et en particulier du diaphragme [Vous devez être inscrit et connecté pour voir ce lien] . Chez le sujet très distendu, le diaphragme s'aplatit et ses zones d'apposition sont très réduites. Dans ces conditions, il a plus un rôle de stabilisateur qu'un rôle inspiratoire proprement dit. La direction transversale des fibres diaphragmatiques par rapport aux côtes inférieures diminue le diamètre de la partie basse de la cage thoracique lors de l'inspiration (signe de Hoover). Le raccourcissement des fibres musculaires diaphragmatiques avec l'hyperinflation les place dans une portion moins favorable de la relation tension-longueur, ce qui diminue leur rendement. Dans ces conditions, le diaphragme a pour rôle principal de prévenir la transmission de la pression pleurale négative, générée par la contraction des muscles intercostaux à l'abdomen et éviter « l'aspiration » de l'abdomen dans le thorax. Ainsi, chez le patient BPCO très distendu, les principaux muscles inspiratoires sont les muscles intercostaux. Les muscles inspiratoires accessoires, essentiellement scalènes et sterno-cléïdo-mastoïdiens, se contractent à chaque cycle. Cette contraction est visible et palpable, elle est d'autant plus importante que l'effort respiratoire est sévère. Les conséquences de l'hyperinflation pulmonaire sur le travail respiratoire sont illustrées dans la [Vous devez être inscrit et connecté pour voir ce lien] . (équation 3)À partir de cette troisième équation, il apparaît que la seule façon de compenser une diminution du flux expiratoire (rapport VT/TE), comme cela est observé en cas de décompensation, est d'augmenter le rapport TE/Ttot.Or, Ttot = TI + TE ; donc si TE/Ttot augmente, TI/Ttot diminue. Ceci n'est possible que si le débit inspiratoire (VT/TI) augmente, ce qui représente une activité inspiratoire accrue. Lorsque cette activité dépasse un certain seuil, une fatigue musculaire peut se développer.Une seconde modalité pour faire face à un accroissement des besoins ventilatoires est l'augmentation du volume pulmonaire, ce qui présente quelques avantages : la pression de recul élastique augmente (force de rétraction contribuant à l'expiration) et les résistances des voies aériennes diminuent avec l'augmentation du volume pulmonaire, ce qui réduit quelque peu le travail résistif expiratoire et stabilise les voies aériennes. Néanmoins cette hyperinflation a des conséquences défavorables sur l'action et la coordination des muscles inspiratoires et en particulier du diaphragme [Vous devez être inscrit et connecté pour voir ce lien] . Chez le sujet très distendu, le diaphragme s'aplatit et ses zones d'apposition sont très réduites. Dans ces conditions, il a plus un rôle de stabilisateur qu'un rôle inspiratoire proprement dit. La direction transversale des fibres diaphragmatiques par rapport aux côtes inférieures diminue le diamètre de la partie basse de la cage thoracique lors de l'inspiration (signe de Hoover). Le raccourcissement des fibres musculaires diaphragmatiques avec l'hyperinflation les place dans une portion moins favorable de la relation tension-longueur, ce qui diminue leur rendement. Dans ces conditions, le diaphragme a pour rôle principal de prévenir la transmission de la pression pleurale négative, générée par la contraction des muscles intercostaux à l'abdomen et éviter « l'aspiration » de l'abdomen dans le thorax. Ainsi, chez le patient BPCO très distendu, les principaux muscles inspiratoires sont les muscles intercostaux. Les muscles inspiratoires accessoires, essentiellement scalènes et sterno-cléïdo-mastoïdiens, se contractent à chaque cycle. Cette contraction est visible et palpable, elle est d'autant plus importante que l'effort respiratoire est sévère. Les conséquences de l'hyperinflation pulmonaire sur le travail respiratoire sont illustrées dans la [Vous devez être inscrit et connecté pour voir ce lien] . Fig. 2. L'hyperinflation influence le travail respiratoire. Les patients atteints d'une BPCO ont un travail résistif (surface pointillée) plus important que les sujets normaux. De plus, comme les BPCO ont un volume de repos plus élevé, ils se déplacent, à volume courant identique, sur la portion plus horizontale de la relation pression-volume, en sorte que le travail élastique (surface hachurée) est également plus important. Enfin, en raison de l'hyperinflation pulmonaire, le volume pulmonaire n'augmente qu'après que les muscles inspiratoires aient généré une pression négative supérieure à l'auto-PEP (AP : auto-PEP), ce qui augmente encore le travail respiratoire.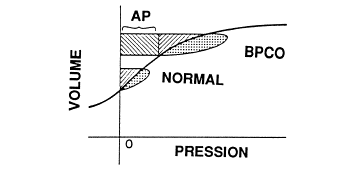 |
Modifications des gaz du sang
Au cours de la poussée aiguë, la majoration de l'hypoxémie et l'hypercapnie est liée à une inhomogénéité accrue des rapports ventilation-perfusion, à une limitation mécanique du système ventilatoire actif et à une modification du mode ventilatoire : fréquence respiratoire augmentée, volume courant diminué.
L'augmentation de l'effet espace mort (de l'ordre de 25 % chez le sujet normal et pouvant atteindre 60 à 80 % chez le patient BPCO en poussée) est responsable de l'hypercapnie. En effet, la PaCO2 est proportionnelle à la production de CO2  et inversement proportionnelle à la ventilation alvéolaire (VA) : et inversement proportionnelle à la ventilation alvéolaire (VA) :
PaCO2 =  (équation 5) (équation 5)
La ventilation alvéolaire est la différence entre la ventilation totale et la ventilation de l'espace mort :
 (équation 6) (équation 6)
VD est l'espace mort physiologique, c'est-à-dire la fraction du volume courant qui ne participe pas aux échanges gazeux. VT est le volume courant. Ainsi, en remplaçant VA dans la première équation, on obtient :
PaCO2 =  (équation 7) (équation 7)
Une élévation de PaCO2 pourrait résulter soit d'une augmentation de production de CO2, soit d'une diminution de la ventilation alvéolaire. Dans la mesure où la  est constante, la diminution de la ventilation alvéolaire est le principal facteur responsable. Cette diminution n'est pas en rapport avec une réduction de la ventilation totale est constante, la diminution de la ventilation alvéolaire est le principal facteur responsable. Cette diminution n'est pas en rapport avec une réduction de la ventilation totale  , mais avec une augmentation de l'effet espace mort [Vous devez être inscrit et connecté pour voir ce lien] . L'importance du VD dépend de la maladie bronchopulmonaire elle-même, alors que VT est un élément dépendant de l'activité des centres respiratoires. , mais avec une augmentation de l'effet espace mort [Vous devez être inscrit et connecté pour voir ce lien] . L'importance du VD dépend de la maladie bronchopulmonaire elle-même, alors que VT est un élément dépendant de l'activité des centres respiratoires.
En cas de poussée aiguë, l'administration d'oxygène aboutit, chez certains patients, à une élévation importante de la PaCO2. Comme la ventilation externe est inchangée [Vous devez être inscrit et connecté pour voir ce lien] , la rétention de CO2 est probablement en rapport avec des modifications de la vasoconstriction pulmonaire hypoxique et de l'effet Haldane. Lorsque la fraction inspirée d'oxygène est basse, la vasoconstriction pulmonaire est active et les vaisseaux perfusant les zones mal ventilées sont fermés (réduction de l'effet shunt) [Vous devez être inscrit et connecté pour voir ce lien] . Cette vasoconstriction, en augmentant les pressions dans le réseau pulmonaire, facilite la redistribution vasculaire vers les territoires ventilés mais faiblement perfusés [Vous devez être inscrit et connecté pour voir ce lien] . Il en résulte donc une diminution de l'effet espace mort et un accroissement des territoires contribuant aux échanges gazeux avec des rapports de la ventilation sur la perfusion proches de 1. Lorsque la FIO2 augmente, la vasoconstriction pulmonaire hypoxique est moins efficace, les résistances pulmonaires baissent, et des territoires mal ventilés sont de nouveau perfusés, alors que d'autres bien ventilés le sont moins. De ce fait, il y a moins de sang veineux en contact avec des alvéoles fonctionnelles (et susceptibles d'excréter du CO2) ; par ailleurs, l'espace mort augmentant et la ventilation minute restant constante, la ventilation alvéolaire diminue et la PaCO2 augmente (équations 6 et 7).
Fig. 3. Modifications de la perfusion en fonction de la FIO2. Lorsque la FIO2 est basse, la vaso-constriction pulmonaire est efficace (partie haute). Lorsque la FIO2 augmente, la vasoconstriction pulmonaire est peu active (partie basse). Les territoires pulmonaires bien ventilés et mal perfusés (effet espace-mort) sous en blanc, les territoires dont le rapport ventilation/perfusion est proche de 1 sont en gris, et les territoires mal ventilés en noir (bas rapport ventilation-perfusion). Ces derniers sont particulièrement sous la dépendance de la vasoconstriction hypoxique. Pour explication, voir texte. L'effet Haldane, qui représente la différence de CO2 transporté, à PCO2 constante, entre le sang oxygéné et le sang réduit par les composés carbaminés et l'hémoglobine, joue également un rôle tout aussi important dans l'élévation de la PaCO2 [Vous devez être inscrit et connecté pour voir ce lien] . Ainsi, le sang pauvrement oxygéné transporte plus de CO2 que le sang oxygéné, d'une part sous forme de bicarbonate et d'autre part en raison d'une meilleure liaison du CO2 à l'hémoglobine. Lorsque ce sang arrive au niveau alvéolaire, il s'oxygène et libère une quantité importante de CO2. Cette excrétion de CO2, en relation avec l'effet Haldane, est inversement proportionnelle à la différence entre la saturation en O2 du sang veineux mêlé et du sang artériel. Plus ce gradient est important, plus le CO2 est relargué. En augmentant la FIO2, la proportion de sang veineux qui parvient au niveau d'unités pulmonaires mal ventilées (et donc peu oxygénées) augmente. Par ailleurs, lorsque la FIO2 passe de 0,2 à 1, l'accroissement de la  sera plus importante (portion verticale de la courbe de dissociation de l'Hb) que celle de la PaO2 (partie horizontale de la courbe de dissociation). Ces deux mécanismes réduisent l'excrétion de CO2 chez les patients porteurs d'anomalies sévères des rapports de la ventilation sur la perfusion en cas de FIO2 élevée, expliquant comment les modifications induites de l'effet Haldane contribuent pour près de 50 % à l'accroissement de la PaCO2. sera plus importante (portion verticale de la courbe de dissociation de l'Hb) que celle de la PaO2 (partie horizontale de la courbe de dissociation). Ces deux mécanismes réduisent l'excrétion de CO2 chez les patients porteurs d'anomalies sévères des rapports de la ventilation sur la perfusion en cas de FIO2 élevée, expliquant comment les modifications induites de l'effet Haldane contribuent pour près de 50 % à l'accroissement de la PaCO2.
Rôle des centres respiratoires
L'activité des centres respiratoires peut être appréciée par la mesure de la pression d'occlusion qui est la pression isovolumétrique générée au cours d'une inspiration effectuée après fermeture des voies aériennes à la CRF [Vous devez être inscrit et connecté pour voir ce lien] . Cette pression est indépendante de la compliante du système respiratoire et de la résistance des voies aériennes. Elle constitue un index global de l'activité inspiratoire cérébrale à condition d'être mesurée 100 millisecondes après le début de l'inspiration chez un sujet éveillé (P0, 1). Chez le patient BPCO, il existe une augmentation de la pression d'occlusion particulièrement importante en cas de décompensation respiratoire aiguë, qui reflète l'hyperactivité inspiratoire centrale nécessaire au maintien d'une ventilation normale.
Cette hyperactivité et la charge imposée aux muscles inspiratoires sont d'autant plus grandes que la fréquence respiratoire est augmentée par rapport aux sujets normaux.
Si la ventilation externe est identique chez le patient BPCO et chez le sujet normal, le mode ventilatoire en revanche est différent. Le patient BPCO a un volume courant plus petit et une fréquence respiratoire plus grande [Vous devez être inscrit et connecté pour voir ce lien] . La diminution du volume courant se fait aux dépens d'une interruption précoce de l'inspiration et non par une diminution du débit inspiratoire. La respiratoire rapide et superficielle traduit une modification des phénomènes qui règlent la durée et l'adéquation des temps respiratoires et non une dépression des centres moteurs chargés de produire le débit inspiratoire [Vous devez être inscrit et connecté pour voir ce lien] . C'est pourquoi la prescription de tout agent analeptique respiratoire est absolument contre-indiquée dans cette situation qu'elle pourrait aggraver.
ÉVALUATION DE LA SÉVÉRITÉ DE LA POUSSÉE
Le plus souvent, le diagnostic positif d'insuffisance respiratoire aiguë chez un patient insuffisant respiratoire chronique obstructif ne pose pas de problèmes. L'interrogatoire peut mettre en évidence une aggravation récente des symptômes avec une dyspnée d'effort majorée, une expectoration qui a augmenté et dont l'aspect s'est modifié, l'apparition d'oedèmes des membres inférieurs. Dans d'autres cas le diagnostic est plus délicat. L'examen clinique recherche les signes évocateurs d'insuffisance respiratoire chronique obstructive sous-jacente comme la distension (thorax globuleux, signe de Hoover, descente inspiratoire de la trachée et du larynx, hypertrophie des muscles respiratoires accessoires, pouls respiratoire) et l'obstruction bronchique (expiration freinée à lèvres pincées, ronchus ou sibilants).
Des problèmes difficiles peuvent être posés lorsqu'il existe une pathologie cardiaque intriquée. Ceci est particulièrement fréquent chez le sujet âgé ayant une insuffisance ventriculaire gauche qui en outre favorise l'hyperactivité bronchique.
L'évaluation de la gravité repose sur l'examen clinique et la gazométrie artérielle.
Examen clinique
Les signes neurologiques témoignent de l'hypoxémie et/ou de l'hypercapnie et ne sont pas corrélés aux anomalies gazométriques, mais plus à la rapidité d'installation de la gêne respiratoire. Les troubles de conscience et l'astérixis seraient surtout des indicateurs de l'élévation de la PaCO2. Les troubles du comportement sont plus en rapport avec une hypoxémie cérébrale.
Les signes cardiovasculaires traduisent le retentissement de l'hypoxémie (tachycardie, cyanose, vasoconstriction cutanée) ou de l'hypercapnie (sueurs, oedème papillaire, céphalées). Les signes d'insuffisance cardiaque droite sont recherchés. En réalité, au cours de l'insuffisance respiratoire chronique obstructive et de sa décompensation aiguë, il y a plutôt une dysfonction cardiaque droite avec augmentation du régime de pression et hyperdébit qu'une insuffisance proprement dite.
Les signes de dysfonction de la pompe ventilatoire ont une valeur pronostique majeure et c'est souvent sur eux que repose la décision de mise en route d'une assistance ventilatoire. Ils témoignent de l'incapacité du système ventilatoire à faire face à la charge à laquelle il est soumis et du développement d'une fatigue. La fréquence respiratoire est un élément objectif d'évaluation et de suivi de la gravité. Il existe des signes directs : activation des muscles du cou (pouls inspiratoire) fréquente à l'état de base chez ces patients et qui est majorée en cas de poussée, tirage sus-sternal, contraction active des muscles expiratoires, respiration paradoxale abdomino-thoracique témoignant d'une dysfonction diaphragmatique sévère. Le degré d'encombrement bronchique est difficile à évaluer objectivement mais est un indicateur de la faillite des mécanismes de défense de l'arbre bronchique.
Gazométrie artérielle
Elle est réalisée au mieux à l'air ambiant, ce qui permet de suivre plus facilement l'évolution des échanges gazeux indépendamment de l'oxygénothérapie. La gazométrie sous oxygène évalue le bénéfice de cette thérapeutique sur la PaO2 et la PaCO2. L'hypoxémie résulte essentiellement d'aggravations des anomalies des rapports de la ventilation sur la perfusion [Vous devez être inscrit et connecté pour voir ce lien] . Elle est en général facile à corriger en dehors de la présence associée d'une pathologie source de shunt vrai (pneumopathie aiguë). La PaO2 n'est donc pas un élément de décision fondamental pour la mise en route d'une assistance ventilatoire. La valeur absolue de la PaCO2 a moins d'importance que la cinétique de son augmentation et les modifications de capnie induites par l'oxygénothérapie [Vous devez être inscrit et connecté pour voir ce lien] . C'est principalement le retentissement de la PaCO2 sur le pH qui est déterminant. L'impossibilité qu'il y aurait à maintenir une PaO2 supérieure à 50 mmHg et un pH supérieur à 7,25 laisse présager de la nécessité d'une assistance ventilatoire [Vous devez être inscrit et connecté pour voir ce lien] .
RECHERCHE DU FACTEUR DÉCLENCHANT DE LA POUSSÉE
La recherche systématique d'un facteur déclenchant doit être menée en parallèle avec la mise en route du traitement.
Surinfection
Il s'agit du mécanisme le plus fréquemment en cause. L'augmentation de la production de sécrétions purulentes et/ou la diminution de leur élimination majorent la charge mécanique (augmentation des résistances) et altèrent les rapports ventilation/perfusion. Les germes les plus souvent incriminés sont le Streptoccoccus pneumoniae et l' Haemophilus influenzae , mais d'autres germes peuvent être présents en particulier Moraxella catarrhalis . S'il existe des signes d'infection parenchymateuse et surtout si le patient a fait de multiples poussées, il est indispensable, s'agissant d'une pathologie pouvant engager le pronostic vital, de réaliser des prélèvements bactériologiques selon les méthodes rigoureuses (prélèvements endobronchiques distaux protégés avec culture quantitative). La question du risque de l'endoscopie bronchique dans ce contexte est souvent posée. Chez un patient ayant une trachéobronchite sans pneumopathie et n'arrivant pas à éliminer ses sécrétions, la fibroscopie améliore parfois la situation en diminuant la charge respiratoire ; en cas de pneumopathie avérée, chez un patient insuffisant respiratoire chronique obstructif sévère, il est rare que la poussée ne débouche pas rapidement sur la nécessité d'une ventilation artificielle ; le risque ajouté par l'endoscopie n'est alors pas majeur.
Maladie thrombo-embolique
Elle est, sur ce terrain, extrêmement difficile à documenter. Un tableau clinique évocateur, une diminution de la capnie alors que l'état respiratoire s'aggrave, des signes de coeur pulmonaire, des signes biologiques de foie cardiaque aigu (cytolyse), sont autant d'éléments qui doivent inciter à poursuivre les investigations. La scintigraphie de perfusion n'est utile que si l'on dispose d'un examen de référence. L'angiographie pulmonaire est difficile à interpréter.
Autres facteurs responsables de poussée
Le pneumothorax est classique mais assez rare ; il est en général très mal toléré et impose un drainage d'autant que les altérations du parenchyme rendent peu vraisemblable le retour spontané du poumon à la paroi.
Les facteurs médicaux sont classiques. La prescription abusive de diurétiques induit une alcalose métabolique avec le furosémide par exemple ; mais ils ne sont pas contre-indiqués dans l'insuffisance respiratoire chronique obstructive : une surcharge hydrosodée importante ou une insuffisance cardiaque gauche associée en justifient l'usage. Les erreurs de gestion de l'oxygénothérapie à domicile, la prise d'antitussifs qui compromettent le drainage des sécrétions respiratoires et surtout de sédatifs susceptibles d'altérer l'activité des centres respiratoires, doit être recherchée.
Certains facteurs associés à l'insuffisance respiratoire chronique obstructive (obésité et cou court, anomalies des voies aériennes supérieures) favorisent les apnées du sommeil qui aggravent la fonction respiratoire.
Au terme de ce bilan initial, il est très important de déterminer non seulement la sévérité de la poussée, mais également son risque évolutif dans les heures qui viennent. Ce dernier point conditionne les modalités de prise en charge du patient : retour à domicile, hospitalisation conventionnelle ou en service de réanimation. Un travail récent précise quels sont les facteurs permettant d'identifier les patients en poussée d'insuffisance respiratoire aiguë sur BPCO et qui ont un risque élevé d'aggravation au décours de la prise en charge initiale [Vous devez être inscrit et connecté pour voir ce lien] . Les facteurs sont les suivants : consultation en urgence dans la semaine précédente, le nombre de doses de bronchodilatateurs administrés par nébulisation lors de la prise en charge initiale au service des Urgences, un traitement par oxygène à domicile, la notion d'antécédents de rechute, l'administration d'aminophylline, la prescription de corticoïdes et d'antibiotiques lors de la prise en charge en urgence [Vous devez être inscrit et connecté pour voir ce lien] . Ces données ont été obtenues sur une cohorte relativement peu importante de patients et doivent être confirmées. Les indications, reconnues par l' American thoracic society (ATS) pour l'hospitalisation des patients en service conventionnel et/ou en unité de soins intensifs sont présentées sur les [Vous devez être inscrit et connecté pour voir ce lien] et [Vous devez être inscrit et connecté pour voir ce lien] .
Tableau I. Indications d'hospitalisation de patients BPCO ayant une poussée aiguë (d'après [Vous devez être inscrit et connecté pour voir ce lien] ). 1 - Patient avec une poussée aiguë, caractérisée par une aggravation de la dyspnée, de la toux, de l'expectoration, plus un ou plus des éléments suivants :
· impossibilité à se mouvoir chez lui (patient précédemment mobile)
· impossibilité à manger ou à  du fait de la dyspnée du fait de la dyspnée
· facteur de co-morbidité élevée associé, pulmonaire (ex. : pneumopathie) ou extrapulmonaire
· aggravation progressive et prolongée de la symptomatologie
· troubles de la conscience
· aggravation de l'hypoxémie
· apparition ou aggravation de l'hypercapnie.
| 2 - Apparition ou aggravation d'un coeur pulmonaire chronique, en répondant pas au traitement initié en ambulatoire.
| 3 - Facteur de co-morbidité associé, susceptible d'aggraver la situation respiratoire
(ex. : myopathie sévère des corticostéroïdes ou tassement vertébral aigu).
| Tableau III. Mesures thérapeutiques pour mobiliser les sécrétions bronchiques en cas de poussée aiguë de BPCO (d'après [Vous devez être inscrit et connecté pour voir ce lien] ). 1 - Toux dirigée (bénéfice escompté par extrapolation de la mucoviscidose)
| 2 - Kinésithérapie respiratoire : bénéfice limité à la phase aiguë
| 3 - Ventilation en pression positive intermittente (IPPB) et pression positive expiratoire :
pas d'indication
| 4 - Aérosolothérapie : pas de bénéfice démontré. Peut provoquer un bronchospasme
| 5 - Hydratation systémique : pas de bénéfice démontré en cas d'euvolémie
| 6 - Aspiration nasotrachéale : bénéfice limité ; tolérée seulement sur une courte période
| 7 - Minitrachéotomie : bénéfice temporaire possible
| 8 - Fluidifiants bronchiques : pas de bénéfice dans cette situation et possiblement délétères
| Tableau IV. Réglage initial du débit d'oxygène pour obtenir une PaO2 > 60 mmHg (d'après ). P aO2 en air ambiant(mmHg)FIO2(%)Débit d'O2 par canulenasale pour obtenir la FIO2(L · min-1) 50
| 24
| 1
| 45
| 28
| 2
| 40
| 32
| 3
| 35
| 35
| 4
|
Fig. 4. Sur un poumon mono-alvéolairormal,l'insufflation du volume courant (VT) débute à la capacité résiduelle fonctionnelle (CRF). En fin d'expiration, le volume pulmonaire est égal à CRF + VT. La vidange pulmonaire est passive et rapide avec un retour à la CRF. Elle dépend des forces de recul du parenchyme (c'est-à-dire de l'élasticité du poumon) et des résistances à l'écoulement gazeux (R). La constante de temps du système est très courte (compliance × résistances) et la durée du temps expiratoire est toujours suffisante. En revanche, en cas de BPCO, le temps expiratoire (TE) est insuffisant en raison d'une constante de temps très allongée (poumon pathologique dont la compliance est élevée et résistances augmentées), pour que le poumon revienne à la CRF avant l'inspiration suivante. Le volume télé-expiratoire est donc égal à CRF + D CRF, DCRF étant l'augmentation du volume pulmonaire par rapport à la CRF. Comme le poumon n'est pas revenu à sa position d'équilibre (CRF), la pression alvéolaire est supérieure à la pression atmosphérique. Ce gradient de pression est appelé auto-PEP.

| |



